力による生体秩序化の多様性と普遍性の解明
2025-2026
A03-14
物理/化学シグナル変換が駆動する細胞競合による組織秩序化機構の解明
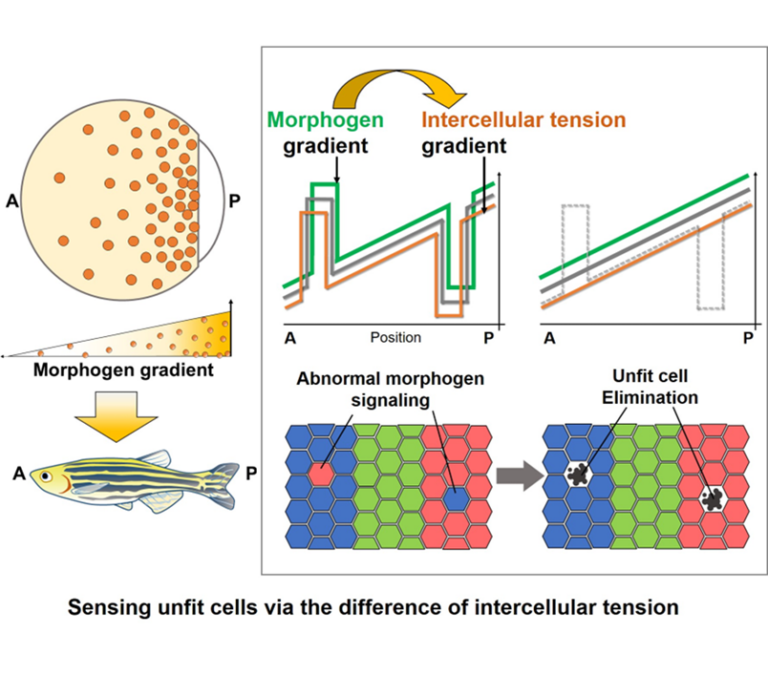
本研究では、動物組織において自然発生する異常細胞を組織が自律的に排除し、秩序だったパターンを維持する仕組みの理解を目指します。異常細胞と隣接正常細胞間における力学的相互作用に着目することで、多様な化学シグナルの異常が力作用の変動を介して隣接細胞に感知されるという、新たな細胞間コミュニケーションの物理化学的基盤を明らかにします。
A03-15
血行力学-熱制御作用による心管腔形成メカニズムの解明
心臓管腔は形成期より常に物理的ストレスに晒されます。これまでの研究から、心管腔形成時、限られた時期と領域でおきる力学応答シグナルを見出してきました。力が恒常的に生じる心管腔内で生体が力学応答を適切に調節する機構は未だに不明です。本課題では、細胞はどのような力の特性を認識しているのか、心臓形成期における「血流から生じる力」と「生体シグナル」に着目し、秩序立った血流循環のために働く心臓管腔構造がどのように形成されるのか把握することを目指します。特に、①ゼブラフィッシュ胚を用いた力を直接操作する手法により血流を模倣すること、②生体シグナルの可視化アプローチの側面から、血流による生体シグナル応答を正しく評価します。そしてどのような物理情報センサーを介するのかに至るまで、作動原理の全容を解明したいと考えています。
A03-16
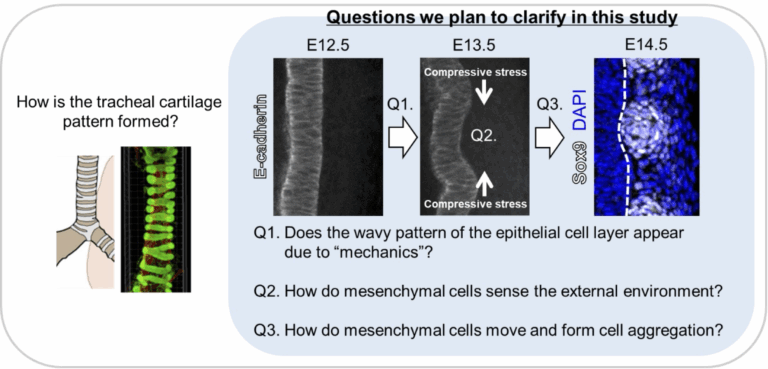
他種組織間で生じる“力”による気管組織の形成原理の解明
我々肺をもつ陸生動物は、様々な動きをしながら呼吸を続けている。この“呼吸の維持”は、どんな動きにも対応できる気管の特殊な組織構造によって叶えられている。気管は管腔組織であり、呼吸を続けるにはこの管腔構造を維持し、換気効率の確保が重要である。首や体を曲げても空気の通り道が維持出来るのは、ジャバラ状の気管軟骨のパターン構造があるためである。気管は、内腔側に上皮組織、その外側を間充織組織(軟骨・靭帯・平滑筋)が覆う二層構造を取る。我々のこれまでの解析により、発生期においてこの二つの組織のやり取りが気管組織形成に重要であるということ、上皮組織層が一時的に変形を生じること、が明らかとなってきた。さらに、我々の解析により、哺乳類(マウス)だけでなく、気管軟骨のパターン構造を有する鳥類(ニワトリ)・爬虫類(ヤモリ)においても、共通の変形が観察されている。そこで本研究では、マウス胚・ニワトリ胚・ヤモリ胚の気管組織を用い、気管の上皮と間充織という異なる組織間の力の相互作用を解析することで、これまで未解明であった“気管軟骨組織のパターン形成原理の解明”に挑み、これが進化的に保存されているかどうかも検証したい。
A03-17
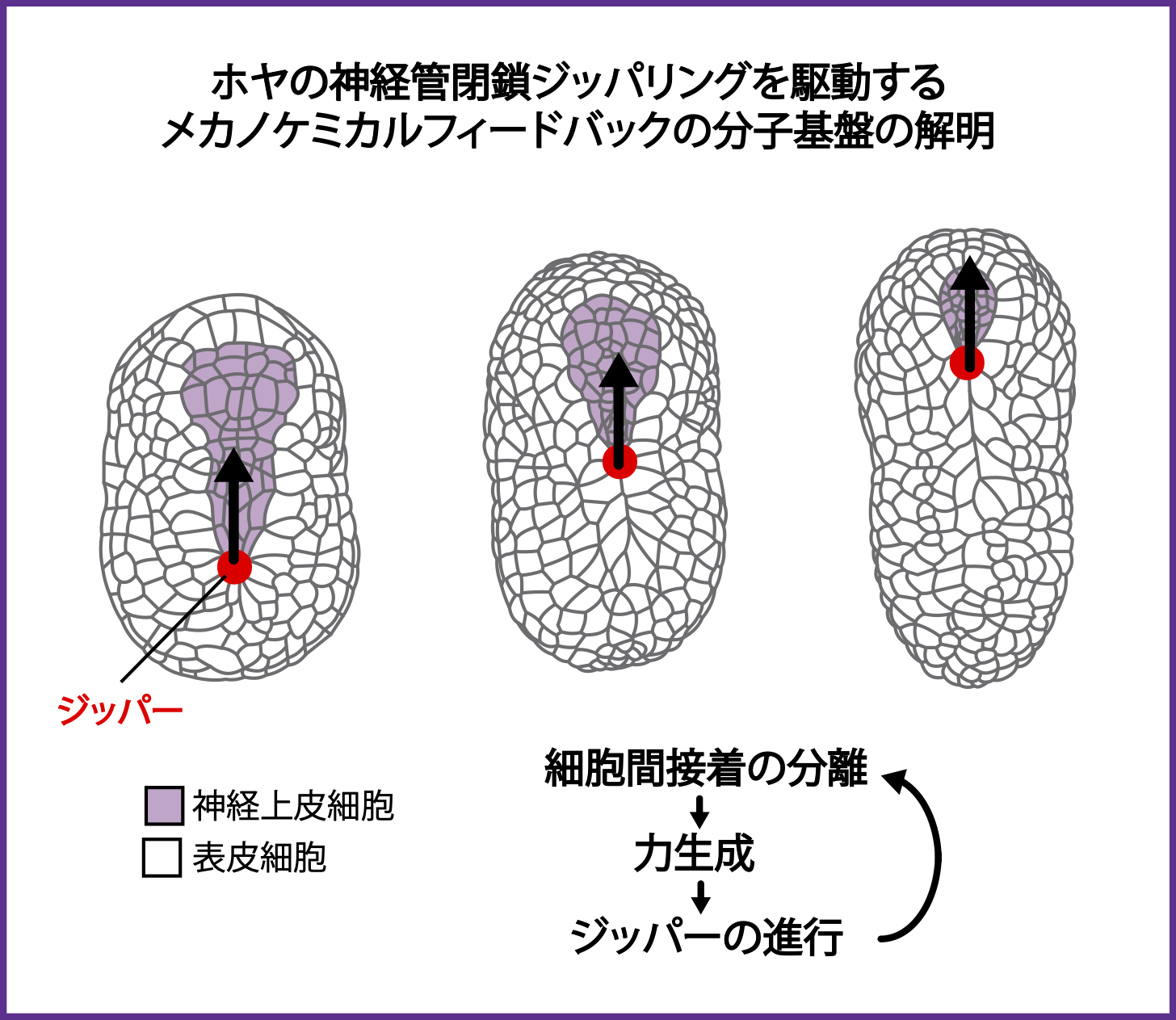
神経管閉鎖を駆動する伝搬性メカノケミカルフィードバックの分子基盤
多細胞運動パターンは生化学シグナルと力生成の動的な相互作用によって自己組織化的に生じ、動物の組織や器官の形を作り上げます。私たちの研究から、機械的な力による細胞間接着の「分離」がホヤの神経管閉鎖ジッパリングの伝搬的な細胞収縮を駆動する生化学シグナルを制御することが見出されました。本研究では、機械的な力による細胞間接着の「分離」がどのようなメカニズムで生化学シグナルを制御するかを解明することで、形態形成における多細胞運動の自己組織化メカニズムの解明を目指します。
A03-18
細胞バリア機能の動的制御を介した管腔構造の自律的成長機構の解析
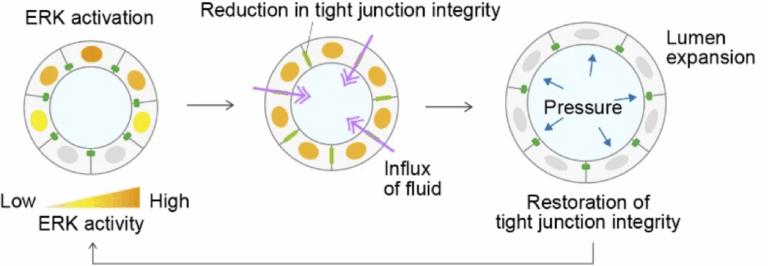
我々の研究では、上皮組織におけるタイトジャンクションの動的制御に着目しています。これまでの研究で、タイトジャンクションの足場タンパク質であるZO-1が細胞集団遊走中にERK活性に応答して細胞底面のポドソーム様構造に移行し、力の発生や細胞外基質の分解に寄与することを発見しました。これに伴い、接着因子の再局在が上皮バリア機能や形態形成にどのような影響を及ぼすのか、という新たな問いが立てられました。本研究計画では、ERK活性とZO-1の局在変化がどのように連携し、タイトジャンクションの形成や管腔の発達を制御しているのかを明らかにすることを目指しています。
A03-19
器官形成期における体軸回転をうみだす生体秩序と力の解明
器官形成期には複数の器官が胚全体の形態形成に関与するため、その力学的発生メカニズムの全容は未だ明らかになっていません。ホヤは、複数の組織や器官の相互作用がどのようにして脊索動物に共通する進化的に保存された胚の形態を生み出すのかを解明するうえで有用なモデルです。本研究では、器官形成期に見られる体軸回転に注目し、ホヤ尾芽胚における形態形成機構をトランススケールで解明することを目的としています。
A03-20
力学的相互作用による細胞骨格の階層的同調メカニズムの解明
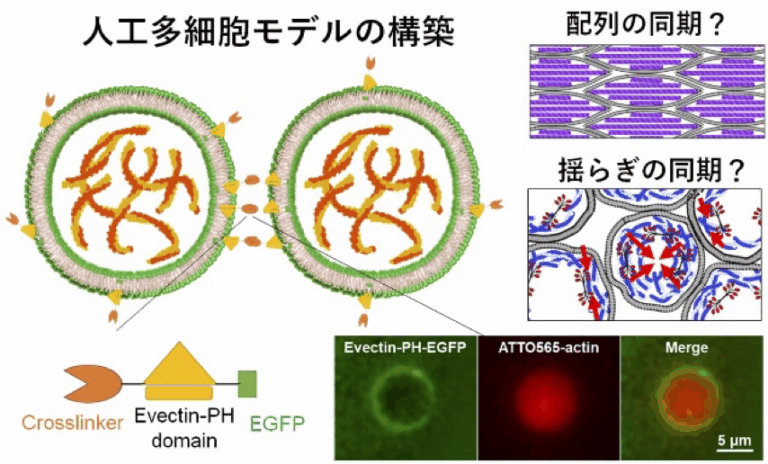
細胞骨格は細胞の力発生や形態形成を担い、メカノセンサーとしても機能しますが、組織全体のマクロな秩序形成への寄与は未解明の部分が多いです。本研究では、人工的に再構築した多細胞モデルを用いて、人工細胞ユニット間の力学的相互作用を介して細胞骨格の動的挙動(ゆらぎや配列変化)が単一細胞の階層を超え、時空間的に変調される機構を明らかにします。
A03-21
液晶の物理学で解く多細胞秩序化と組織形成の力学基盤
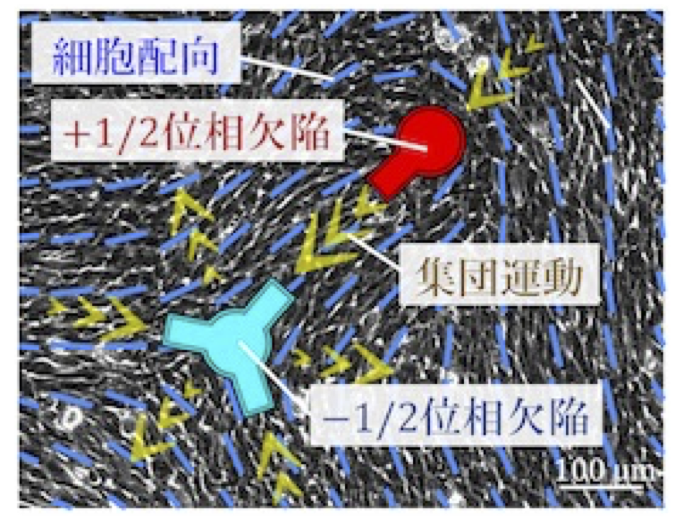
細胞は集団を成すことで生体組織を構築しており,向きを揃えた細胞集団の配向性は多細胞形態を支える主たる要因である。細胞集団には配向が急激に変化する「位相欠陥」と呼ばれる特異点があり,秩序だった生体組織には位相欠陥が規則的に配置することが知られるが,背後にあるメカニズムは明らかではない。本研究では,細胞集団に現れる位相欠陥の配置を制御する新技術を開発し,欠陥配置の規則性が組織形態の秩序性を定める原理を解明する。さらに,配置制御に関わるシグナル伝達系と細胞が発する収縮力の操作から,効果的な力伝達が多細胞系の隆起構造を誘導することを明らかにする。
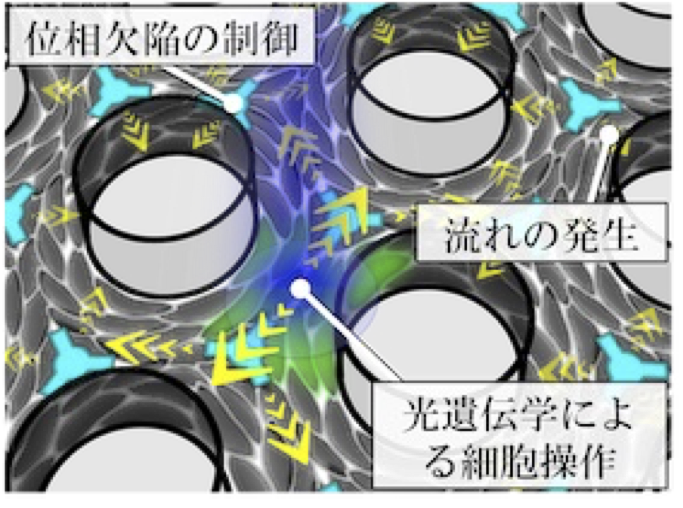
A03-22
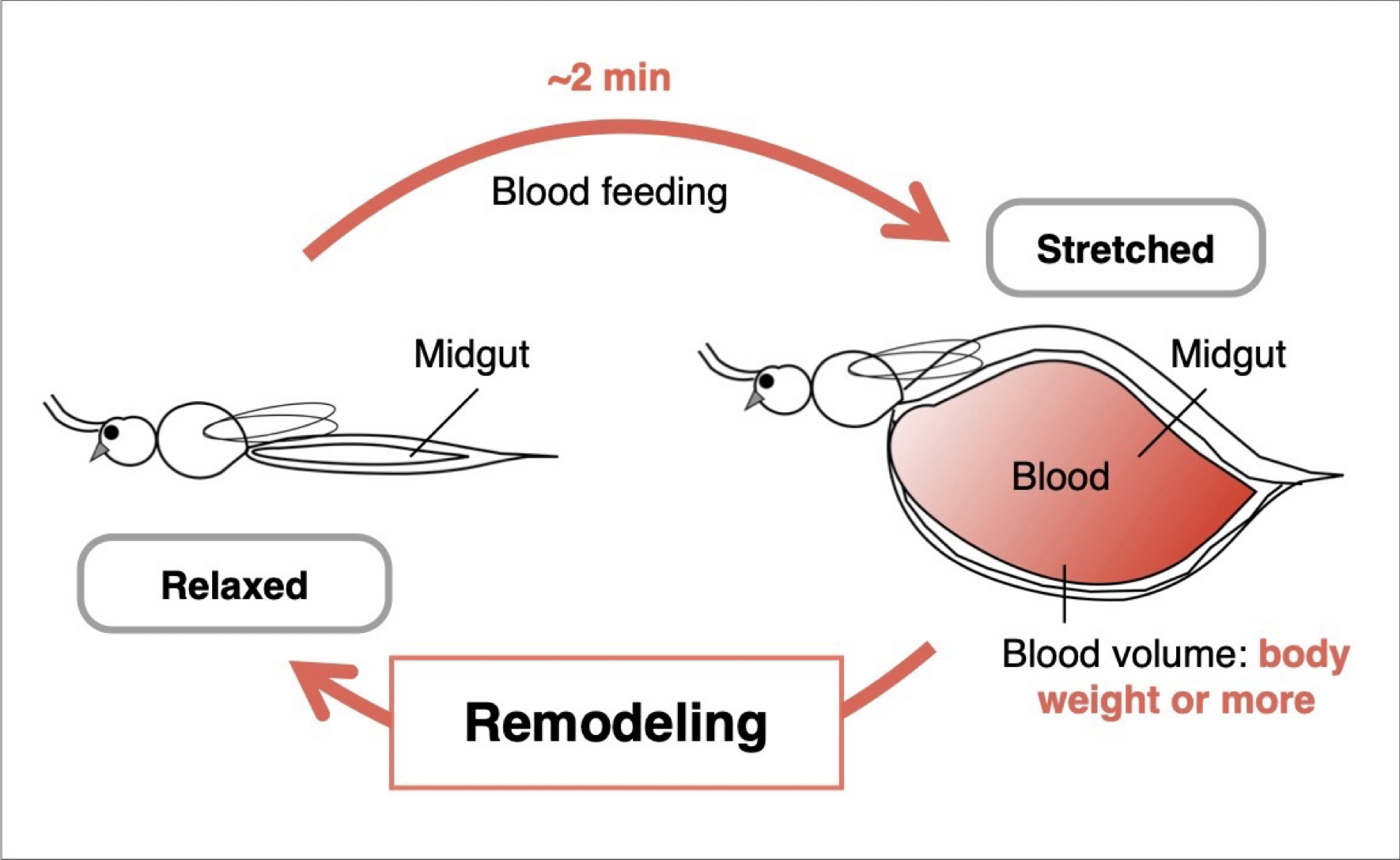
吸血による力学刺激が導く蚊の中腸リモデリング
吸血性節足動物である蚊は、わずか2分間の吸血によって、自らの体重と同等あるいはそれ以上の量の血液を摂取します。このとき、中腸は急激に膨張し、その後、血液の消化・吸収の進行に伴って段階的に収縮します。こうした中腸の動的な構造変化は、単なる物理的変形にとどまらず、新たな組織構造を形成する秩序だった再構築プロセスと捉えることができます。本研究では、蚊の中腸が飽血状態に至った後に進行するリモデリング過程に着目し、中腸上皮細胞における吸血依存的な力覚応答のメカニズムを解明することを目指します。
A03-23
細胞-ECM相互作用で作る力の秩序が周期性組織構造を創発する原理の解明
生物の器官の大半は管腔で作られているが、その形態は器官ごとに異なり、多様な形態形成原理が寄与していると考えられています。これまでのモデル生物を使った発生学研究は、上皮組織の変形こそが器官固有の形態形成の起点であるという視点で研究されてきました。しかし、最近になって上皮を裏打ちする間充織組織が形態形成に重要な役割を果たすことがわかってきました。私たちの研究室では呼吸器の発生、再生に着目した研究を行っています。今回の研究で対象とする気管は、鼻腔/口腔から吸入した空気を肺まで誘導する道管です。気管を包むC型軟骨は管腔の内径を保持する硬さを与え、一定間隔の繰り返し構造を作ることで適度な柔軟を与えるため、その形態が正確に構築されないと、深刻な先天性疾患に至ります。本研究は、哺乳類の気管における軟骨の繰り返し構造をモデルとし、細胞-ECM 相互作用で発生する力の制御が軟骨細胞の自己組織化を誘導する可能性を検証します。私たちは先行研究から、軟骨前駆細胞に亜集団がいることを発見しました。マウス遺伝学、胎児気管ex vivo培養、多能性幹細胞からの分化誘導とマイクロ加工を使った気管軟骨細胞の動態解析を統合した研究を実施することで、軟骨細胞亜集団が先導する細胞移動によって周期的な凝集が自己組織化されるという仮説を実証します。

A03-24
力覚を通じて形成される細胞極性が駆動する器官形態形成機構とその普遍性(II)
()
A03-25
細胞性粘菌の組織伸長から紐解くアメーボゾアの力学マシナリー
多細胞の自律的秩序形成の背景には、細胞と基質、細胞と細胞間に働く力と、細胞の運動状態が整合的に働く仕組みが不可欠と考えられます。動く細胞による多細胞構築は後生動物の外でもみられますが、動物と類似の仕組みが働いているのか、あるいは固有な仕組みがあるのか、ほとんどわかっていません。本研究では、アメーボゾア界の細胞性粘菌に注目し、組織伸長とインターカレーションの動態測定、ならびに組織形状測定から推定される表面張力の調節からその力学的仕組みを探ります。

A03-26
時空間ダイナミクス計測による臓器形成・再生におけるYAP力学恒常性制御機構の解明
A03-27
肢芽と尾をモデルとした突出して発生する器官の伸長メカニズムの多様性と普遍性の解明
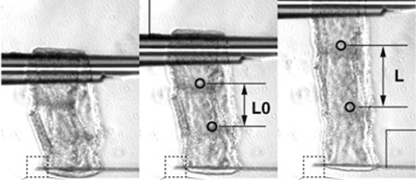
本公募研究では、肢芽に代表されるような、突出して発生する器官の伸長は、「伸長方向とは垂直方向に配向する上皮組織の力学的拘束により、内部の間充織の伸長方向がその方向に制限されるため、器官全体が遠位側に向かって一方向に伸長する、という普遍的な発生原理があるのではないか」、との仮説を2年間で検証することを目的とする。具体的には、本研究では、ニワトリ胚の肢芽と尾(しっぽ)の伸長過程をモデルとして用い、突出した器官の形態形成メカニズムの多様性と普遍性を次の5つの視点に着目して解明することに挑戦する。①上皮組織の応答能の視点:間充織細胞からの内圧により上皮組織が応答し細胞の配向が決まるのかを、間充織の内圧を変化させるための間充織細胞への細胞の注入により間充織の形状を人工的に変形させたときの上皮組織の応答より解析する、②間充織組織の応答能の視点:肢芽の間充織を単離し、培養を行いながら前後軸ではなく遠近軸方向に人工的に組織を圧縮した時の間充織の細胞群の秩序の変化(細胞集団のanisotropy)を解析する、③普遍的な形態形成メカニズムの視点:しっぽについてもこれまで肢芽で行ってきた実験と同様の実験を行い、肢芽としっぽの発生での細胞の応答能の普遍性を解析する、④突出した器官の自律的な形成メカニズムの視点:発生初期の器官の形状が上皮組織の細胞の配向性を自律的に決めるのかどうか、シミュレーションにより上皮組織内部にかかる応力の方向性を解析する、⑤間充織における内圧の3次元評価:蛍光dropletの注入により内圧の方向性を直接評価する。本研究により、これまでの組織間相互作用の概念を“上皮と間充織の間の力のやりとりを含めた組織間相互作用”として捉え直し、再定義することにより、器官全体が上皮と間充織の間で力を介して自律的に形態形成を行うという、発生生物学における新たな概念を提唱する。
2023-2024
A03-1
物理/化学シグナルの変換を介した細胞競合による組織自律性維持機構の解明
本研究では、動物組織において自然発生する異常細胞を組織が自律的に排除し、秩序だったパターンを維持する仕組みの理解を目指します。異常細胞と隣接正常細胞間における力学的相互作用に着目することで、多様な化学シグナルの異常が力作用の変動を介して隣接細胞に感知されるという、新たな細胞間コミュニケーションの物理化学的基盤を明らかにします。

A03-2
血行力学作用による心管腔組織形成の制御
心臓管腔は形成期より常に物理的ストレスに晒されます。これまでの研究から、心管腔形成時、限られた時期と領域でおきる力学応答シグナルを見出してきました。力が恒常的に生じる心管腔内で生体が力学応答を適切に調節する機構は未だに不明です。本課題では、細胞はどのような力の特性を認識しているのか、心臓形成期における「血流から生じる力」と「生体シグナル」に着目し、秩序立った血流循環のために働く心臓管腔構造がどのように形成されるのか把握することを目指します。特に、①ゼブラフィッシュ胚を用いた力を直接操作する手法により血流を模倣すること、②生体シグナルの可視化アプローチの側面から、血流による生体シグナル応答を正しく評価します。そしてどのような力覚センサーを介するのかに至るまで、作動原理の全容を解明したいと考えています。

A03-3
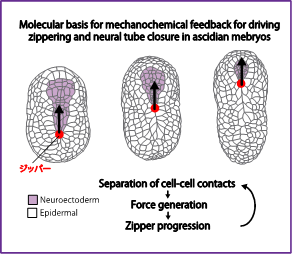
ホヤの神経管閉鎖ジッパリングを駆動するメカノケミカルフィードバック
動物の発生における組織や器官の形づくりでは、力学作用と生化学反応が細胞間でフィードバックすることで秩序だった細胞集団の運動が自己組織化的に創発されます。海産無脊椎動物であるホヤの胚は、透明で発生がはやく、組織や器官構築プロセスにおいて細胞数が少ないため、個々の細胞がいつ、どこで物理的な力を生成し、それらの力がどのように周辺細胞と統合され組織や器官の形が作られるかを解明することができます。そのため組織や器官の形づくりにおける自己組織化的な細胞集団運動の解明する上でホヤは優れたモデル生物です。私たちの研究から、ホヤの神経管閉鎖ジッパリングの細胞集団運動を制御する新しいメカノセンシング-応答の仕組みとして、細胞間接着の「分離」を介して機械的な力を生化学シグナルに変換することが見出されました。本研究では、細胞間接着の分離がどのようなしくみで生化学シグナルを制御するかを明らかにします。この目的を達成することで、自己組織化的な細胞集団運動パターンの構築原理の全容解明の基盤を構築します。
A03-4
尾芽胚の軸回転を制御する生体秩序と力の解明
器官形成期の胚全体の形づくりは複数の器官が関与するため発生力学的な理解は進んでいません。ホヤは組織・器官間の相互作用が脊索動物共通の胚の形にどのように寄与するか理解するための興味深いモデルを提供します。本研究では器官形成期の脊索動物胚でみられる軸回転機構について細胞レベルから個体レベルまでトランス・スケールでの理解を目指します。

A03-5
長距離に伝播する力が制御する器官形成の新規機構
腸管上に自発的に出現する「ぜん動波」は長距離に伝播する力作用として考えることができます。本研究では、トリ胚の腸を対象に光遺伝学や生体イメージングを駆使して、ぜん動波が腸の器官形成を制御する仕組みを解明し、マクロスケールの器官形成を可能とする基本原理を理解することを目指します。
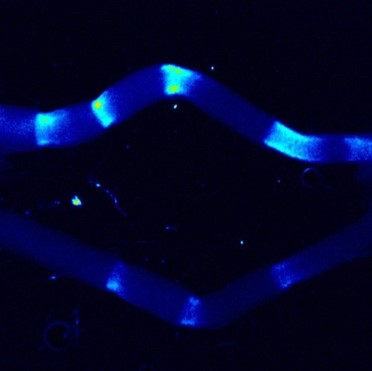
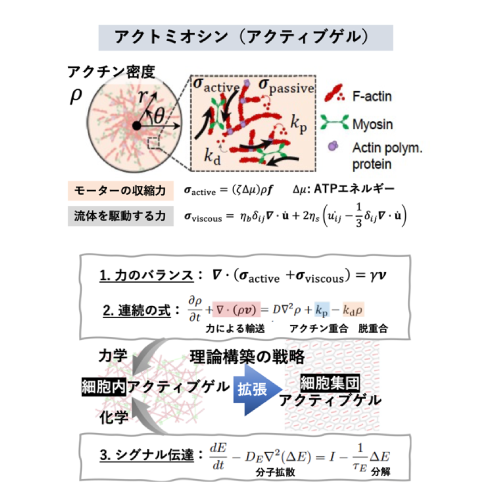
A03-6
アクティブゲル物理学で解き明かす細胞骨格の動的秩序形成と力学化学クロストーク
細胞骨格アクトミオシンの収縮力は細胞内の対称性や構造形成を制御することが知られており、これらのタンパク質が出す力とマクロな細胞の秩序化を繋ぐことは生物物理学の主要課題です。本研究はアクトミオシンの力学理論「アクティブゲルモデル」を構築し、力による細胞骨格の秩序化の理論的枠組みを構築します。さらに理論モデルを細胞集団へ拡張し、力を介した多細胞秩序化原理を解明します。
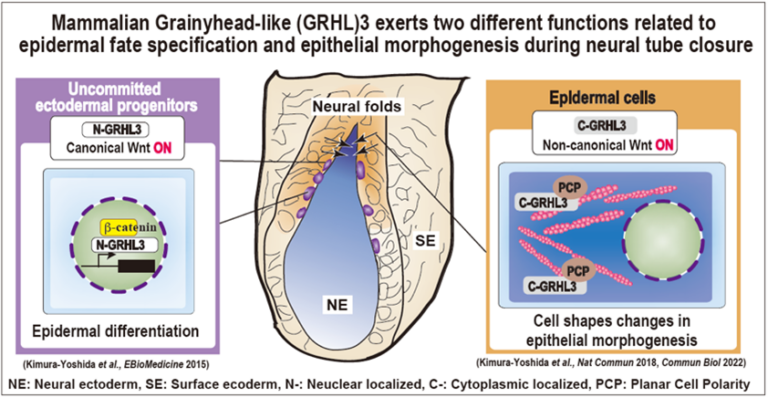
A03-7
神経管閉鎖過程における力作用と化学反応との連携機構の解明
研究代表者のグループは、神経管の閉鎖過程で表皮と神経の境界領域(神経摺)に存在する特異な細胞群とそこで特異的に発現するGRHL3因子に注目して研究を進めてました。神経摺領域の細胞は、神経管閉鎖前は未分化状態ですが、カノニカルWntシグナルによってGRHL3が転写因子として核内で発現することで、表皮化されます。更に、表皮への分化後GRHL3は核から細胞質へと局在を変え、細胞質でノンカノニカルWntシグナルの1種である平面細胞内極性経路を活性化することで、アクチン豊富で強靭な表皮細胞へと変化させます。このように細胞褶が細胞運命と形態変化することで、神経管閉鎖運動が円滑に進行することが可能となっていることが想定されます。そこで、本研究課題では、GRHL3陽性の神経摺細胞がどのように上皮層内の力作用をセンシングし、細胞内のシグナル経路を調節して神経管閉鎖運動を組織化しているのか分子レベルで明らかにします。
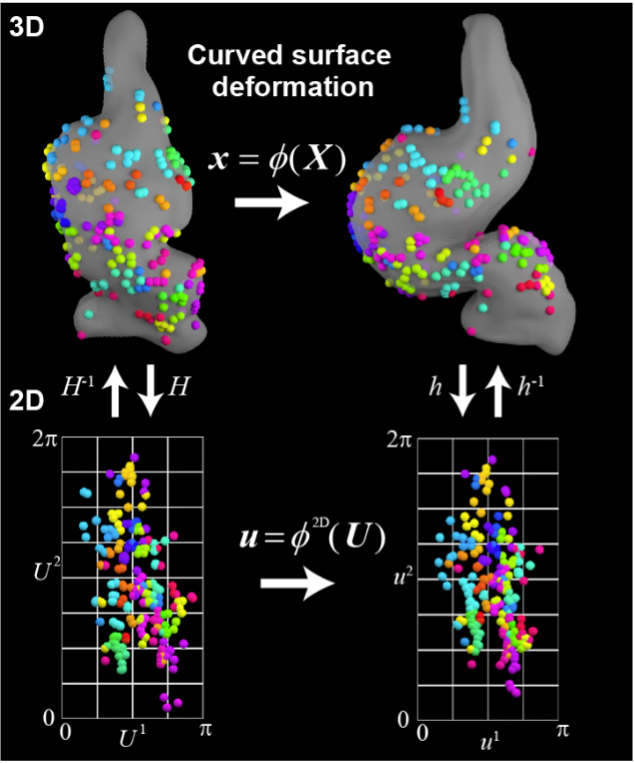
A03-8
力覚を通じて形成される細胞極性が駆動する器官形態形成機構とその普遍性
本研究では、器官固有の形態の決定に重要な細胞集団運動や組織変形で見られる極性動態と細胞力覚の関係性を解明します。前脳と心臓の初期発生過程を主な対象とし、器官間で共通した形態形成機構を探ります。
A03-9
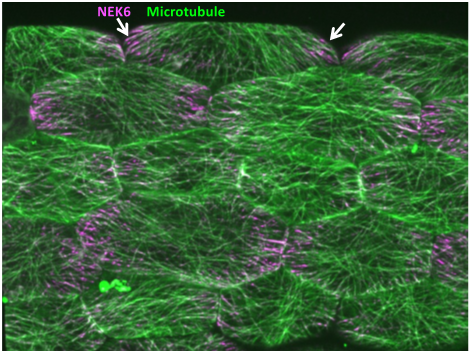
植物の成長と姿勢を統御するメカニカルフィードバックの解析
生物の形態形成では、形やサイズが絶えまなく変化していくため、不安定性を必然的に内包しています。この絶え間ない時空間的な変化に対応し、安定した器官形成を行うためには、体の各部位の相対的な位置を認識し、全体の形にフィードバックする自己受容機構が必要です。植物では、形態形成に伴って発生する張力がシグナルとなり、細胞骨格の微小管の配向変化を引き起こし、個々の細胞と器官全体の成長が協調されるメカニカルフィードバックが提唱されていますが、その機構は未だ不明です。そこで本研究では、メカニカルフィードバックの要となる、微小管が張力方向に並ぶメカニズムを解明します。私たちは、張力に応答して局在を変化させるユニークな性質を持つNIMA関連キナーゼを見出しました。NIMA関連キナーゼを手がかりとして張力応答のイメージングと張力応答機構の解析を行います。また、張力応答を制御するタンパク質の解析と新規因子の探索を行います。
A03-10
原始後生動物における個体再編成を制御する力学-化学クロストークの解明
本研究では、原始後生動物が個体レベルの再生や再編成を実現する力学-化学クロストークの実体や自己組織化メカニズムの解明を目指します。エダアシクラゲを使って、個体再編成におけるパターン形成を実現する仕組みを細胞や分子レベルで明らかにすることで、複雑に進化した高等動物にも共通する自己組織化の普遍的原理を追求します。

A03-11
YAPメカノホメオスターシスによる再生の力学制御機構の解明
進化過程において重力などの外力に抗して生理機能を維持する抗外力恒常性が獲得されたと考えられるが、その機構は不明な部分が多い。再生時に働く自己組織化において「臓器サイズに応じてかかる外力の力学情報を、臓器内の細胞がどのように感知し、臓器細胞の増殖分化・自己組織化を促し再生が起こるのか?。臓器サイズが元に戻ると、どのようにしてそれらが停止するのか?」という臓器の抗外力恒常性のメカニズムは十分に理解されていない。
私たちは、体と臓器の扁平化を起こすhirameメダカ変異体の分離・解析から、原因遺伝子YAPが重力に抗した3次元臓器を構築・拡大するメカニズムを見だした。その本質は、YAPのアクチン重合制御による細胞張力であり、細胞張力が細胞の積み重ねによる3D組織形成と、それらの正しい配置を連携して3D臓器や体を構築することを示した。後者の3D組織の配置は、細胞外基質と細胞間の双方向性の力学制御を介している。この双方向性の力学制御は、細胞の増殖・分化を制御し組織ホメオスターシスを維持することからメカノホメオスターシス(力学恒常性: “外力に押されたら押し返す”メカニズム)と呼ばれる。私たちの解析はYAPがその制御因子であることを示していることからYAPメカノホメオスターシスと名付けた。
本研究では、再生にYAPは必須であることから、再生過程でのYAP活性化、細胞外基質の力学特性などの動態計測を行い、YAPメカノホメオスターシスの作動原理の解明をめざす。
A03-12
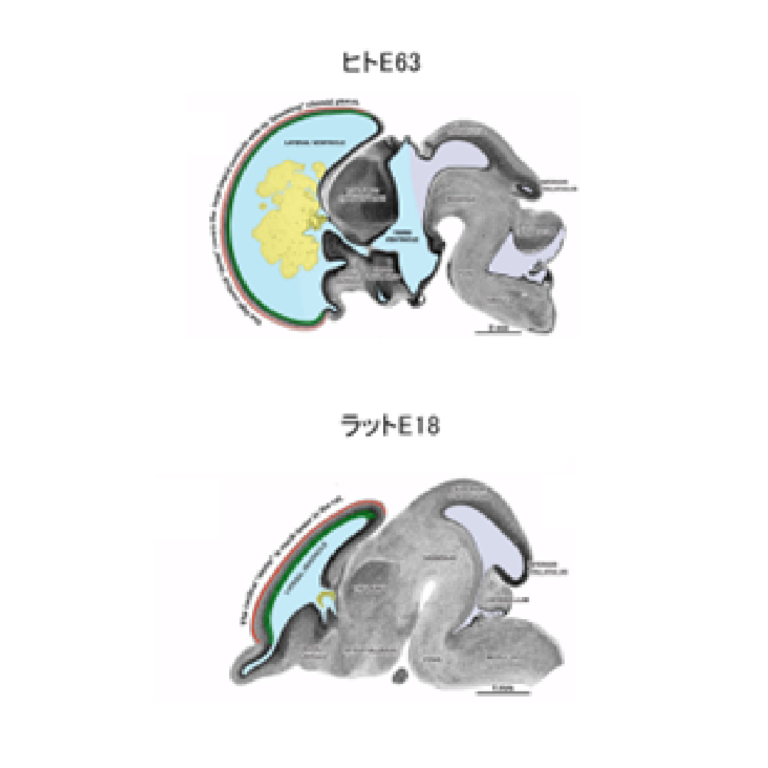
脳室内圧による脳発生の新規秩序の解明
私たちは、脳脊髄液を介した脳室内圧の力学作用が脳発生にはたす役割について研究を行います。特に、神経幹細胞が増殖から分化モードへ移行する時期の調節、およびそれに伴う脳胞の神経幹細胞プールのサイズ調節に焦点を絞って研究を進めており、微小空間である胚の脳室内圧の測定法を確立し、発生に伴う変化や、脳サイズの異なる種間で比較することを計画しています。本研究によってもたらされる知見は、脊椎動物の脳進化、脳の形成異常(小脳症、巨脳症など)、および脳オルガノイド研究に貢献する可能性があります。
A03-13
力の組織間相互作用の解析による肢芽全体の伸長メカニズムの解明
本公募研究は、ニワトリ胚の肢芽をモデルとして用い、異なる組織である肢芽の上皮と間充織の間の力の相互作用を解析することで、これまで未解明であったパターン形成後の「肢芽全体の器官が遠近軸方向に沿って自律的に伸長するメカニズム」の解明に挑みます。
我々のこれまでの研究で、肢芽の上皮組織内部には伸長方向(遠近軸)とは垂直方向の前後軸方向に沿って応力の値が5倍高く、応力の異方性があることを発見しました。そこで本研究では次のマクロとミクロの2つの視点から、上記の解明を行います。
①マクロな視点:組織培養を用いた、肢芽の上皮組織内部の応力の時空間的な定量解析、及び上皮組織の物性(ヤング率)の測定により、内部の間充織細胞全体に圧縮力を生み出すメカニズムを解明します。
②ミクロな視点:力と細胞応答の関係及び力を生み出すメカニズムを細胞レベルで理解するために、応力の異方性を生み出す上皮組織の細胞動態と力を生み出す責任分子の局在、力を受け取った間充織の細胞群の秩序の変化(細胞集団のanisotropy)をミクロレベルで解析します。
これまで発生生物学においては、肢芽の伸長メカニズムの研究は主に分泌因子の発現を元に、上皮と間充織の間の組織間相互作用や、それに関わる遺伝子の解析が行われてきました。本研究により、これまでの組織間相互作用の概念を“上皮と間充織の間の力のやりとりを含めた組織間相互作用”として捉え直し、再定義することにより、マクロな肢芽全体の器官の伸長メカニズムの解明に挑戦します。





















